열역학 제1법칙 정의
열역학 제 1법칙 정리
열역학 제 1법칙 실생활
열역학 제1법칙과 제2법칙
열역학 제1법칙 식
열역학 0법칙
열역학 제3법칙
열역학 제1법칙 예시
주제에 대한 기사를 찾고 있습니까 “열역학 제 1 법칙“? 웹사이트에서 이 주제에 대한 전체 정보를 제공합니다 c2.castu.org 탐색에서: 974 사진을 다운로드할 수 있는 최고의 웹사이트. 바로 아래에서 이 주제에 대한 자세한 답변을 찾을 수 있습니다. 찾고 있는 주제를 더 잘 이해하려면 끝까지 읽으십시오.
이미지를 휴대폰에 다운로드하려면 이미지를 2초 동안 두 번 클릭한 다음 “이미지 다운로드” 다운로드를 선택하여 이미지를 다운로드할 수 있습니다.
컴퓨터에서 이미지를 다운로드하려면 이미지를 클릭한 다음 “다른 이름으로 이미지 저장”을 선택하여 다운로드할 수 있습니다.
▶ 열역학 제 1법칙의 의미는, 검사질량이 상태변화를 하는 동안 에너지는 열 혹은 일의 형태로 경계면을 통과할 수 있으며 각각은 양 혹은 음의 값이 될 수 있음을 의미한다. 시스템 내부에서 에너지의 정미 변화량은 시스템 경계면을 통과하는 에너지의 정미량과 정확히 일치한다.
Table of Contents
열역학 제 1 법칙 주제와 관련된 상위 41 이미지
주제 열역학 제 1 법칙 와 관련된 28 개의 이미지가 있습니다.
6. 열역학 제1법칙(열과 일의 관계 : 쥴의 실험) :: Chemical Engineering
위 그림은 쥴의 실험을 나타낸 그림이에요. 쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고, 물의 온도변화를 측정하는 실험을 했어요. 이 실험에서 에너지의 형태는 추의 위치에너지에서 운동에너지로 바뀌고, 회전날개의 기계적인 일로 바뀌고, 물의 내부에너지로 바뀌어서 저장됩니다. 이 실험을 통해 계에 기계적인 일을 가해 물의 온도를 변화시킬 수 있다는 것을 알게 되었어요. 물론 직접 열을 가해도 물의 온도를 변 화 시킬 수 있겠죠? 쥴을 이 실험을 통해 열과 일이 동등하다는 것을 증명해냈어요. 그 결과가 1cal = 4.2J입니다. 1cal의 열이 4.2J의 일의 크기와 같다는 의미에요. 다시말해서, 쥴의 실험은 일과, 열 그리고 내부..
- Image source: 5crown.tistory.com
- Views: 37200
- Publish date: 24 hours ago
- Downloads: 13358
- Likes: 5767
- Dislikes: 7

쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고,
나가는 일을 -Wsys 라고 하고, surrounding에서 받는 열은 +Qsurr , +Wsurr 이라고 할 수 있어요.
다시말해서, 쥴의 실험은 일과, 열 그리고 내부에너지가 서로 형태 가 바뀌어 전달되고 저장되는 것을 증명한 실험이에요.
6. 열역학 제1법칙(열과 일의 관계 : 쥴의 실험) :: Chemical Engineering
위 그림은 쥴의 실험을 나타낸 그림이에요. 쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고, 물의 온도변화를 측정하는 실험을 했어요. 이 실험에서 에너지의 형태는 추의 위치에너지에서 운동에너지로 바뀌고, 회전날개의 기계적인 일로 바뀌고, 물의 내부에너지로 바뀌어서 저장됩니다. 이 실험을 통해 계에 기계적인 일을 가해 물의 온도를 변화시킬 수 있다는 것을 알게 되었어요. 물론 직접 열을 가해도 물의 온도를 변 화 시킬 수 있겠죠? 쥴을 이 실험을 통해 열과 일이 동등하다는 것을 증명해냈어요. 그 결과가 1cal = 4.2J입니다. 1cal의 열이 4.2J의 일의 크기와 같다는 의미에요. 다시말해서, 쥴의 실험은 일과, 열 그리고 내부..
- Image source: 5crown.tistory.com
- Views: 77531
- Publish date: 8 minute ago
- Downloads: 69583
- Likes: 7044
- Dislikes: 3

쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고,
나가는 일을 -Wsys 라고 하고, surrounding에서 받는 열은 +Qsurr , +Wsurr 이라고 할 수 있어요.
다시말해서, 쥴의 실험은 일과, 열 그리고 내부에너지가 서로 형태 가 바뀌어 전달되고 저장되는 것을 증명한 실험이에요.
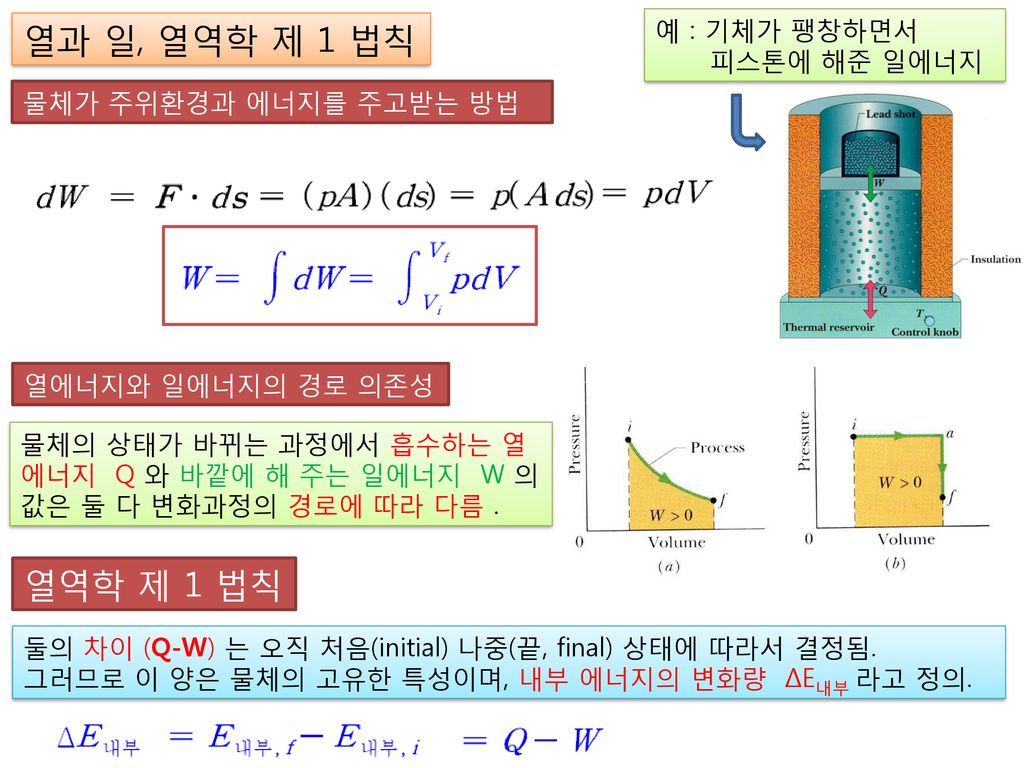
Ch.3. 지구화학을 위한 열역학 제 1 법칙 The First Law 에너지 보존 법칙 – ppt download
dU = dQ – PdV (1) 압력이 일정한 상태에서 , 외부와 열 교환을 하는 피스톤 시스템 내부에너지 변화는 다음과 같다 내부에너지 변화는 다음과 같다 내부에너지 변화량= 열량 변화 + 받은 일 DU = DQ +DW = DQ – PDV 미소 변화량(infinitesimal change)에 대해서 dU = dQ – PdV (1)
- Image source: slidesplayer.org
- Views: 101365
- Publish date: 12 hours ago
- Downloads: 5909
- Likes: 3043
- Dislikes: 1

We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
화학반응 속도론 Chapter 14. 화학반응속도론 열역학적 관점 – 이 반응이 일어날까 ? 속도론적 관점 – 얼마나 빨리 반응이 진행될까 ? 반응속도는 반응물과 생성물의 농도가 시간에 따라 변하는 것을 가지고 나타낸다 (M/s). A B rate = – [A] tt.
일반화학 ( 최종호교수님 ) 지정 좌석 배치도 (101 명 / 115 석 ) 교단 DOORDOOR 황승태황승태 김지수김지수 이성종이성종 김보람김보람 신유림신유림 한성화한성화 박세인박세인 박성현박성현 유연경유연경 조용현조용현 정재형정재형 이창혁이창혁 김민겸김민겸 권나솔권나솔.
6. 열역학 제1법칙(열과 일의 관계 : 쥴의 실험) :: Chemical Engineering
위 그림은 쥴의 실험을 나타낸 그림이에요. 쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고, 물의 온도변화를 측정하는 실험을 했어요. 이 실험에서 에너지의 형태는 추의 위치에너지에서 운동에너지로 바뀌고, 회전날개의 기계적인 일로 바뀌고, 물의 내부에너지로 바뀌어서 저장됩니다. 이 실험을 통해 계에 기계적인 일을 가해 물의 온도를 변화시킬 수 있다는 것을 알게 되었어요. 물론 직접 열을 가해도 물의 온도를 변 화 시킬 수 있겠죠? 쥴을 이 실험을 통해 열과 일이 동등하다는 것을 증명해냈어요. 그 결과가 1cal = 4.2J입니다. 1cal의 열이 4.2J의 일의 크기와 같다는 의미에요. 다시말해서, 쥴의 실험은 일과, 열 그리고 내부..
- Image source: 5crown.tistory.com
- Views: 105948
- Publish date: 24 hours ago
- Downloads: 76848
- Likes: 4748
- Dislikes: 6

쥴은 그림과 같은 장치를 설치하고, 높은 곳에 위치한 추가 낙하 하면서 비커 안의 회전날개를 회전 시키도록 장치를 만들고,
나가는 일을 -Wsys 라고 하고, surrounding에서 받는 열은 +Qsurr , +Wsurr 이라고 할 수 있어요.
다시말해서, 쥴의 실험은 일과, 열 그리고 내부에너지가 서로 형태 가 바뀌어 전달되고 저장되는 것을 증명한 실험이에요.
024. 엔탈피의 정의와 열역학 제1법칙 [[슈퍼브레인 열역학]] – YouTube
댓글로 질문 받지 않습니다~! 질문은 페이스북 그룹이나 홀릭스(holix.com)에서 해주세요~!SuperThanks 많이 이용해주시고 후원도 해주세요후원계좌 우리은행 256-515651-02001 (이상복)제휴 간접광고 문의 : [email protected]↓↓↓교재는…
- Image source: m.youtube.com
- Views: 46231
- Publish date: 24 hours ago
- Downloads: 67216
- Likes: 1856
- Dislikes: 4
![024. 엔탈피의 정의와 열역학 제1법칙 [[슈퍼브레인 열역학]] - Youtube](https://i.ytimg.com/vi/rrxaShOT2Rg/maxresdefault.jpg)
Cách YouTube hoạt động
Liên hệ với chúng tôi
Chính sách và an toàn
Ch.3. 지구화학을 위한 열역학 제 1 법칙 The First Law 에너지 보존 법칙 – ppt download
dU = dQ – PdV (1) 압력이 일정한 상태에서 , 외부와 열 교환을 하는 피스톤 시스템 내부에너지 변화는 다음과 같다 내부에너지 변화는 다음과 같다 내부에너지 변화량= 열량 변화 + 받은 일 DU = DQ +DW = DQ – PDV 미소 변화량(infinitesimal change)에 대해서 dU = dQ – PdV (1)
- Image source: slidesplayer.org
- Views: 97197
- Publish date: 8 minute ago
- Downloads: 80811
- Likes: 5702
- Dislikes: 1

We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
화학반응 속도론 Chapter 14. 화학반응속도론 열역학적 관점 – 이 반응이 일어날까 ? 속도론적 관점 – 얼마나 빨리 반응이 진행될까 ? 반응속도는 반응물과 생성물의 농도가 시간에 따라 변하는 것을 가지고 나타낸다 (M/s). A B rate = – [A] tt.
일반화학 ( 최종호교수님 ) 지정 좌석 배치도 (101 명 / 115 석 ) 교단 DOORDOOR 황승태황승태 김지수김지수 이성종이성종 김보람김보람 신유림신유림 한성화한성화 박세인박세인 박성현박성현 유연경유연경 조용현조용현 정재형정재형 이창혁이창혁 김민겸김민겸 권나솔권나솔.
온도, 열, 열역학 제 1 법칙 온도측정 측정과정 역학 : 물체의 운동과 역학적 에너지의 변화 뉴턴의 운동법칙 – ppt download
일정부피 기체 온도계 – 절대온도 일정부피 기체 온도계 절대온도 T 의 정의 T = C p p : 온도계 기체의 압력 (실제 재는 양: p = p0-ρgh ) C : 비례상수 (물의 삼중점을 기준으로 결정) 끓는 물의 절대온도를 일정부피 기체 온도계로 잰 결과 P3 가 작아지면 기체 종류에 관계없이 K 로 수렴함
- Image source: slidesplayer.org
- Views: 82019
- Publish date: 54 minute ago
- Downloads: 69243
- Likes: 8686
- Dislikes: 6
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
열역학 I : 온도, 열, 열전달. Newton 운동 역학의 과정 1. 1 체 문제 ( 질점 ) : 병진운동, 진동운동 3. 2 체 문제 : 병진, 회전, 진동운동 가능 2. 충돌 4. 강체 (rigid body) 무수히 많은 질점으로 구성되며, 병진, 회전운동이 일어난다.
Homework #1 연관규칙, 분류, 클러시트링의 세 가지 마이닝 방법에 대해, 교재 및 강의노트에 나오지 않는 사례를 각각 1개씩 드시오. 교재 p. 86의 2번 문제 교재 p. 91의 19번 문제 문서는 각 단어의 빈도를 조사하여 문서 벡터로 나타낼 수 있다. 문서.
5. 열역학 제1법칙(열 : 열의 성질) :: Chemical Engineering
< 열의 성질 > 이번엔 열역학 제1법칙을 구성하는 일과 열 중에서 열에 대해서 살펴 볼 거에요. 열이라고 하는 것은 계의 경계를 통해서 system과 surrounding, 계와 주위 사이에 전달되는 에너지의 한 형태에요. 그렇다면 열은 어떤 성질을 가지고 있을까요? 질량 m인 물체에 열Q를 가해서 ∆T만큼의 온도가 변했다면, 똑같은 물체에 가해지는 열을 2배로 늘리면 온도변화가 2배가 됩니다. 즉, 전달되는 열은 온도변화와 관련이 있어요. 그리고, 질량 m인 물체에 열Q를 가해서, ∆T만큼의 온도가 변했는데, 가해지는 열을 2배로 늘리고, 질량도 2배로 늘리면, 온도변화는 ∆T만큼만 변해요. 즉, 전달되는 열은 물질의 양과 관련이 있습니다. 그리고, 같은 질량의 Cu와 물을 똑같이 온도를 변화시키기 ..
- Image source: 5crown.tistory.com
- Views: 54377
- Publish date: 5 hours ago
- Downloads: 71090
- Likes: 8896
- Dislikes: 3

기체에 대해서는 압력이 일정한 상태에서의 비열 값과 부피가 일정한 상태에서의 비열 값이 다르다는 것을 이 실험을 통해서 알 수 가 있어요.
그리고, 같은 질량의 Cu와 물을 똑같이 온도를 변화시키기 위해서는 구리에 가해진 열보다 11배나 많은 열을 물에다가 가해야지만 해요.
다시 말해서, 물을 예로 들면, 물의 비열은 4.2J/g・K인데, 물의 양이 많던, 적던 비열은 4.2J/g・K로 동일하다는 얘기에요.
- Image source: www.studocu.com
- Views: 93945
- Publish date: 2 minute ago
- Downloads: 66490
- Likes: 3042
- Dislikes: 6

Chapter 19 열역학 제1법칙. – ppt download
열역학 과정의 중요한 형태를 상세하게 기술하기 19장의 목표 열역학과정에서 열과 일의 연관성 살펴보기 열역학 제1법칙 알아보기 열역학 과정의 중요한 형태를 상세하게 기술하기 열역학을 이상기체에 적용하기 단열과정 알아보기 19-2
- Image source: slidesplayer.org
- Views: 2953
- Publish date: 28 minute ago
- Downloads: 6883
- Likes: 685
- Dislikes: 9

We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
위치에너지. 1. 5kg 의 물체가 2m 높이에 있을 때 물체의 위치에너지는 ? 2. 2m 높이에 있던 2kg 의 물체를 7m 높이까지 들어올렸을 때 물체에 해 주어야 할 일은 ? U= mgh = 5 x 9.8 x 2 = 98 [J] U 2 =9.8 x 2 x 2 U.
물 1 g(1 cm3)이 1 atm 의 일정한 압력 하에서 끓으면 1,671 cm3 의 증기가 된다. 이 압력하에서 기화열은 LV = 2.256106 J/kg 이다. (a) 기화할 때 물에 의하여 행해지는 일 (b) 물의 내부 에너지 증가를 계산하여라.
2. 열역학 제1법칙(일: PV work) :: Chemical Engineering
열역학 제1법칙은 에너지 보존법칙으로써, 열과 일에 대한 관계를 말해주는 법칙이에요~ 먼저 일에 대해서 알아봅시다. 열역학에서 일은 팽창일과 비팽창일로 나눌 수 있어요. 기체의 부피가 팽창하면서 행하는 팽창일이나, 기체를 압축하는데 필요한 압축일을 PV work라 하고, 전기적인 일이나, 화학적인 일을 비팽창일(non-PV work)이라고 해요. 제가 자주 영어로 말씀드릴 건데, 그건 한국말로는 제대로 전달되지 않거나 의미전달에 혼동이 있을 수 있기 때문에 그래요. 어떤 사람은 비열이나, 비부피, 비엔탈피 처럼 비팽창일을 specific work라고 이해하는 사람도 있거든요. 비팽창일은 건전지, 화학전지 같은 전기화학적인 일을 의미하는겁니다. 자, 그럼 팽창일 PV work에 대해서 살펴봅시다. 힘 F를..
- Image source: 5crown.tistory.com
- Views: 52937
- Publish date: 31 minute ago
- Downloads: 78349
- Likes: 2968
- Dislikes: 5

P에 대해서 정리하면, $P=\frac{nRT}{V}$ 가 되고, 적분식에 대입하면, $ W=-\int_{V_1}^{V_2}\frac{nRT}{V}dV $
외부압력은 Pex4로 일정하게 유지되고, 부피변화는 Vf-Vi, 압축일은 Pex4*(Vf-Vi)가 되므로, PV선도에서는 파란색 사각형 면적이 됩니다.
(위 아래의 세번째 그림이 가역팽창 일과 가역 압축일을 나타내는 그림인데, 보시다시피 가역공정의 경우는 팽창과 압축이 같은 경로를 지나는 것 보이죠?)
2-8 이상기체의 열역학 : 압축공기참고서
◆이상기체의 열역학 <매우중요(Very Important)>공기압축기에서 이상기체 열역학적 상태 변화는 크게 보면 모든 부분에서 모두 이루어진다. 그러나 이걸 계산하기는 쉽지 않다. 그래서 이해를 하려면 개별적으로 분석하여 전체적인 개념을 이해해야 한다. 반드시 이해하고 넘어가야 한다. (1) 이상기체의 열역학적 상태 변화 : 이상기체의 열역학적인 상태 변화란 어느 이상기체의 온도, 압력, 부피 등의 물리량 이 변화되는 과정을 의미한다.초기 열역학적 상태에서 나중 열역학적 상태로의 변화 열역학적 상태 : 압력, 부피, 온도가 일정하게 유지되는 하나의 상태로 이상 기체의 열역학적 상태는 이상 기체 상태 방정식을 통해 압력, 부피, 온도 중 두 가지 물리량만 결정되면 나머지 열역학 함수들을 계산할 수 있다. 온도, 압력, 부피가 모두 변하는 과정은 복잡한 수학 지식이 수반되어야 하므로 우선한 가지 물리량은 고정하고 나머지 두 가지 물리량의 변화에 따른 과정을 정리한다.(2) 가역 등압 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.(3) 가역 등적 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.(4) 가역 등온 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다. 온도변화가 없다면 운동에너지 변화가 없으므로 등온 과정에서는 내부 에너지 변화가 없다.(5) 가역 단열 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.가역변화(reversible change) – 엔트로피 변화의 총합이 0(zero)인 변화비-가역적인 변화가 아닌 변화 즉, 어떤 변화에서 하나의 시스템이 열역학적 상태 S1로부터 시작해서 상태 S2에 도달케 한 다음, 다시 상태 S1로 복귀시키는 경우에, 사용할지도 모르는 다른 물체도 사용 전의 역학적 상태로 복귀시킬 수 있을 때, S1에서 S2로의 변화를 가역변화라고 한다.예를 들면 마찰이 없는 진공 속에서 운동하는 진자는 운동에너지와 위치에너지가 상호 전환하여 주기적으로 원상태로 복귀한다. 이와 같은 변화 즉, 하나의 역학적 상태에서 다른 역학적 상태로의 변화를 반복할 수 있는 경우를 가역변화라 한다. 비-가역변화(irreversible change) – 엔트로피 변화의 총합이 증가물체에 어떤 변화를 가한 다음, 그 상태를 다시 변화 전의 원래의 상태로 복귀시키는 경우, 이때 물체 자신이 다시 원래의 상태로 복귀하면서 다른 어떤 변화를 주위에 남길 경우를 비-가역변화라 한다. (가능한 모든 방법을 사용해도)예를 들면 고온물체와 저온물체를 서로 접촉하면 언젠가는 서로 온도가 같아지게 된다. 그러나 이들을 다시 원래의 온도로 복귀시키고자 할 경우, 고온물체는 가열해야 하고, 저온물체는 냉각시켜야 한다. 가열 또는 냉각시키기 위해서는 별도의 장치를 필요로 하며, 또 주위의 대기 등에 어떤 변화를 남기게 된다. 엔탈피(enthalpy)열역학적 상태를 표시하는 물리량의 하나. 물체 내부 에너지와 밖에서 가해진 압력으로 인한 부피 변화량을 합한 것, 즉 H=U+pV(U는 내부 에너지, p는 압력, V는 부피)로 정의된다. 엔트로피(entropy)열역학에서 중요한 제1법칙은 에너지보존의 법칙, 즉 우주에 존재하는 에너지 총량은 일정하며 절대 변하지 않는다는 것이다. 제2법칙은 대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 이미 진행된 변화를 되돌릴 수 없다는 의미이다. 따라서 자연 물질계의 변화는 엔트로피의 총량이 증가하는 방향으로 진행한다. 이것을 엔트로피 증가의 법칙이라고 한다. 즉 가용할 수 있는 에너지는 일정한데 자연의 물질은 일정한 방향으로만 움직이기 때문에 무용한 상태로 변화한 자연현상이나 물질의 변화는 다시 되돌릴 수 없다는 것이다. 즉 다시 가용할 수 있는 상태로 환원시킬 수 없는, 무용의 상태로 전환된 질량(에너지)의 총량을 '엔트로피(entropy)'고 한다.
- Image source: kiesa.kr
- Views: 95572
- Publish date: 5 hours ago
- Downloads: 27725
- Likes: 5530
- Dislikes: 5

열역학에서 중요한 제1법칙은 에너지보존의 법칙, 즉 우주에 존재하는 에너지 총량은 일정하며 절대 변하지 않는다는 것이다. 제2법칙은 대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 이미 진행된 변화를 되돌릴 수 없다는 의미이다. 따라서 자연 물질계의 변화는 엔트로피의 총량이 증가하는 방향으로 진행한다. 이것을 엔트로피 증가의 법칙이라고 한다. 즉 가용할 수 있는 에너지는 일정한데 자연의 물질은 일정한 방향으로만 움직이기 때문에 무용한 상태로 변화한 자연현상이나 물질의 변화는 다시 되돌릴 수 없다는 것이다. 즉 다시 가용할 수 있는 상태로 환원시킬 수 없는, 무용의 상태로 전환된 질량(에너지)의 총량을 ‘엔트로피(entropy)’고 한다.
초기 열역학적 상태에서 나중 열역학적 상태로의 변화 열역학적 상태 : 압력, 부피, 온도가 일정하게 유지되는 하나의 상태로 이상 기체의 열역학적 상태는 이상 기체 상태 방정식을 통해 압력, 부피, 온도 중 두 가지 물리량만 결정되면 나머지 열역학 함수들을 계산할 수 있다. 온도, 압력, 부피가 모두 변하는 과정은 복잡한 수학 지식이 수반되어야 하므로 우선한 가지 물리량은 고정하고 나머지 두 가지 물리량의 변화에 따른 과정을 정리한다.
예를 들면 고온물체와 저온물체를 서로 접촉하면 언젠가는 서로 온도가 같아지게 된다. 그러나 이들을 다시 원래의 온도로 복귀시키고자 할 경우, 고온물체는 가열해야 하고, 저온물체는 냉각시켜야 한다. 가열 또는 냉각시키기 위해서는 별도의 장치를 필요로 하며, 또 주위의 대기 등에 어떤 변화를 남기게 된다.
- Image source: godjunpyo.com
- Views: 62682
- Publish date: 6 hours ago
- Downloads: 36150
- Likes: 2970
- Dislikes: 5
![열역학 제대로 끝내기 1&2 법칙 [9강] 밀폐계(피스톤-실린더, 기체+액체) 5 – 갓준표의 4대역학](https://godjunpyo.com/wp-content/uploads/kboard_attached/6/202206/62a4ad0e56b981893895.png)
열역학 제2장
Free essays, homework help, flashcards, research papers, book reports, term papers, history, science, politics
- Image source: studylib.net
- Views: 28509
- Publish date: 4 hours ago
- Downloads: 77503
- Likes: 8029
- Dislikes: 10

You can add this document to your study collection(s)
You can add this document to your saved list
Is the category for this document correct?
비디오 열역학 제 1 법칙 열역학 제 1법칙이 대체 무엇일까?
- Source: Youtube
- Views: 92126
- Date: 45 minute ago
- Download: 80840
- Likes: 3113
- Dislikes: 3
주제에 대한 관련 정보 열역학 제 1 법칙
Bing에서 열역학 제 1 법칙 주제에 대한 최신 정보를 볼 수 있습니다.
열역학 제1법칙 정의
열역학 제 1법칙 정리
열역학 제 1법칙 실생활
열역학 제1법칙과 제2법칙
열역학 제1법칙 식
열역학 0법칙
열역학 제3법칙
열역학 제1법칙 예시
주제에 대한 기사 보기를 마쳤습니다 열역학 제 1 법칙. 이 기사가 유용했다면 공유하십시오. 매우 감사합니다.
열역학 제1법칙 정의
열역학 제 1법칙 정리
열역학 제 1법칙 실생활
열역학 제1법칙과 제2법칙
열역학 제1법칙 식
열역학 0법칙
열역학 제3법칙
열역학 제1법칙 예시