이상기체상태방정식 기체상수
이상기체 상태방정식 문제
이상기체 상태방정식 유도
이상기체 상태 방정식 활용
이상기체 상태방정식 조건
이상기체상태방정식 밀도
이상기체 상태 방정식 단위
이상기체 가정
주제에 대한 기사를 찾고 있습니까 “이상 기체 상태 방정식“? 웹사이트에서 이 주제에 대한 전체 정보를 제공합니다 c2.castu.org 탐색에서: 292 사진을 다운로드할 수 있는 최고의 웹사이트. 바로 아래에서 이 주제에 대한 자세한 답변을 찾을 수 있습니다. 찾고 있는 주제를 더 잘 이해하려면 끝까지 읽으십시오.
이미지를 휴대폰에 다운로드하려면 이미지를 2초 동안 두 번 클릭한 다음 “이미지 다운로드” 다운로드를 선택하여 이미지를 다운로드할 수 있습니다.
컴퓨터에서 이미지를 다운로드하려면 이미지를 클릭한 다음 “다른 이름으로 이미지 저장”을 선택하여 다운로드할 수 있습니다.
Table of Contents
이상 기체 상태 방정식 주제와 관련된 상위 35 이미지
주제 이상 기체 상태 방정식 와 관련된 18 개의 이미지가 있습니다.
이상기체 법칙 – 위키백과, 우리 모두의 백과사전
- Image source: ko.wikipedia.org
- Views: 87130
- Publish date: 20 hours ago
- Downloads: 100994
- Likes: 2248
- Dislikes: 8

고대시대의 아르키메데스(Archimedes)는 물질의 기본적인 성질인 부력과 밀도를 이해하는 데 기여하였다. 이를 바탕으로 갈릴레오 갈릴레이(Galileo Galilee)가 실험을 통해 공기에 무게가 있다는 사실을증명했고, 용액의 온도에 따라 물질의 밀도가 달라진다는 것을 보여주는 기계를 만들었다. 이러한 갈릴레오의 활동은 훗날 기체의 역학운동에 대한 탐구에 좋은 길잡이가 되었다. 이후 토리첼리(Torricelli)는 수은 기압계를 만들었으며 기체가 힘을 매개하는 매개체가 될 수 있음을 밝혔다. 파스칼은 유체에서 압력은 모든 방향으로 동등하게 손실 없이 전달된다는 사실로부터
이상 기체 법칙은 실험으로 측정한 거시적 행동과 구성 분자의 구조 및 상호작용을 연결 시킨 최초의 예이다. 또한 이 법칙으로부터 도출된 이상기체 상태방정식은 기체 분자 운동론의 기본이 되는 식이다. 이 식은 보일, 샤를, 게이-뤼삭 및 아보가드로의 법칙 등이 서로 연관되며 발전 종합되어 만들어진 식이며, 이 식을 통해 실제 기체에 대한 접근을 하면서 반데르발스 방정식이 나왔고, 또한 이 식은 계속 진화해가고 있다.
실제 기체는 근사적으로 대개 이상 기체 법칙을 따르며, 기체의 밀도가 0에 가깝거나 기체의 온도가 매우 높으면 이상 기체 법칙에 더 잘 맞게 된다. 그 이유는 밀도가 0에 가까워지면 분자의 운동시 기체 분자끼리 부딪히는 정도가 적어지고 분자 자신의 부피를 무시할 정도가 된다. 또 고온이 됨으로써 분자의 운동이 고속이 되어 분자 간의 힘이 무시할 만한 정도가 되기 때문이다.
기체 5.1 기체로 존재하는 물질 5.2 기체의 압력 5.3 기체 법칙 5.4 이상 기체 방정식 5.5 기체의 화학량론 – ppt download
기체의 화학 기체의 화학은 화학의 태동에서부터 매우 중요한 역할을 해 왔다.대부분의 1학년 학생들은 기체의 화학을 중학교나 고등학교에서 배운 보일의 법칙이나 샤를의 법칙 또는 이상기체 방정식을 이해하면 충분하다고 생각할 수 있으나, 기체의 화학은 그 역할이 그보다 매우 크고 중요하다. 물론 출발은 이상기체 방정식이지만, 여기에서 온도의 의미가 나타나고, 또한 기체 분자의 운동과 그 너머의 화학동력학 등을 밝혀냈고, 뿐만 아니라, 상평형, 물질의 화학퍼텐셜 등 화학열역학이 모두 기체의 화학에서 출발한다. 기초를 분명하게 하는 것이 매우 중요하다.
- Image source: slidesplayer.org
- Views: 48738
- Publish date: 19 hours ago
- Downloads: 32347
- Likes: 3783
- Dislikes: 3

기체의 화학은 화학의 태동에서부터 매우 중요한 역할을 해 왔다.대부분의 1학년 학생들은 기체의 화학을 중학교나 고등학교에서 배운 보일의 법칙이나 샤를의 법칙 또는 이상기체 방정식을 이해하면 충분하다고 생각할 수 있으나, 기체의 화학은 그 역할이 그보다 매우 크고 중요하다. 물론 출발은 이상기체 방정식이지만, 여기에서 온도의 의미가 나타나고, 또한 기체 분자의 운동과 그 너머의 화학동력학 등을 밝혀냈고, 뿐만 아니라, 상평형, 물질의 화학퍼텐셜 등 화학열역학이 모두 기체의 화학에서 출발한다. 기초를 분명하게 하는 것이 매우 중요하다.
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
라오디게아 교회의 교훈 본문 계 3: ○라오디게아 교회의 사자에게 편지하라 아멘이시요 충성되고 참된 증인이시요 하나님의 창조의 근본이신 이가 이르시되 15. 내가 네 행위를 아노니 네가 차지도 아니하고 뜨겁지도 아니하도다 네가 차든지 뜨겁든지 하기를 원하노라.
상태 방정식 – 위키백과, 우리 모두의 백과사전
- Image source: ko.wikipedia.org
- Views: 38596
- Publish date: 58 minute ago
- Downloads: 56877
- Likes: 3086
- Dislikes: 1

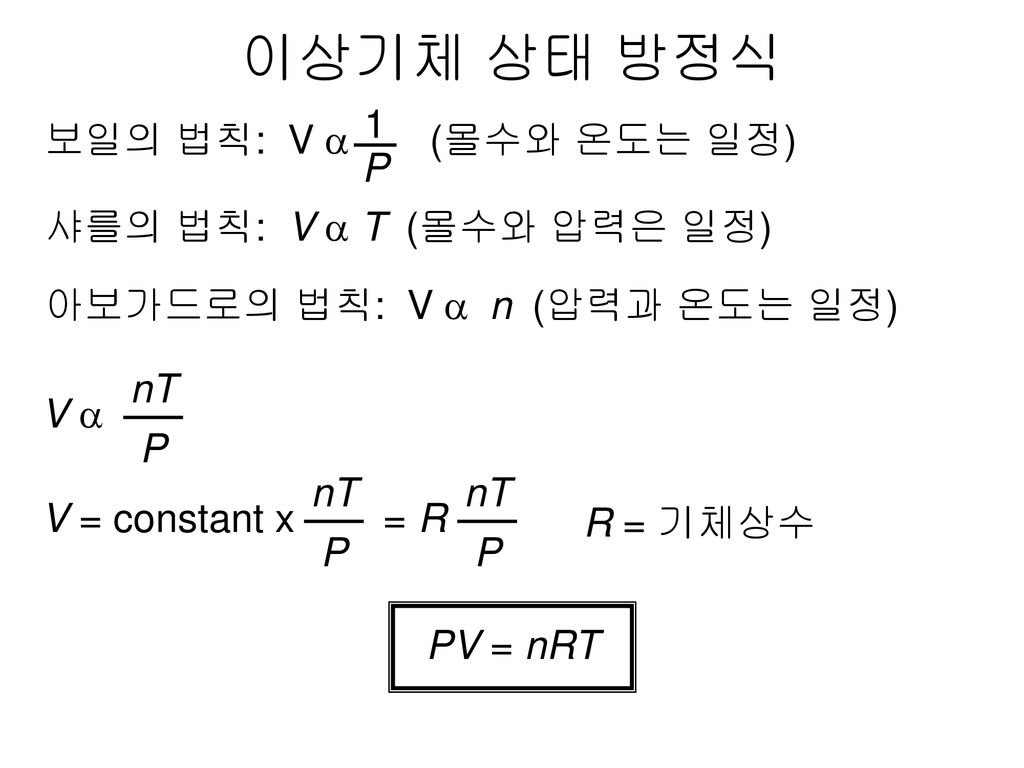
(Equation of state)은 이상 기체의 상태 방정식을 의미한다. 이상기체의 상태방정식이란, 압력, 온도, 기체의 몰수, 부피 사이의 관계를 나타낸 수식으로, P[atm], V[L], n[mol], T[K] 사이의 식은 PV=nRT이다. 이때, R은 기체상수로써, 0.08214atmL/molK 또는 8.3145J/molK의 값을 가진다.
예시를 들어, 10mol의 기체가 1기압, 27С에 있다면 이 기체의 부피는 246L임을 위의 식으로부터 알아낼 수 있다.
https://ko.wikipedia.org/w/index.php?title=상태_방정식&oldid=31916699
물리 음향학: 상태방정식(equation of state) :: 오피쓴의 너드라이프
음향 파동방정식을 유도하기 위한 세 번째 단계는 상태방정식(equation of state)입니다. 상태방정식은 열역학(thermodynamics)에서 자세히 다루어집니다. 따라서, 오늘 글에는 열역학 내용이 많은 담겨 있습니다. 열역학을 접해보지 못한 분들을 위해, 최대한 글을 간단하고 명료하게 쓰려 노력했습니다. 여러분들도 글을 읽으실 때, 수학같은 것보다는 전체적인 흐름을 이해하시려 하면 좀 더 읽기 수월할 것입니다. 심지어 음향 파동방정식 유도를 위한 상태방정식 최종식에 도달하는 수학은 생략하였습니다. 이번 글이 어렵게 느껴지신다면 여러분들이 부족한 것이 아니라, 제 학문의 깊이와 글짓기 실력이 부족한 것이니 너그럽게 용서해 주시기 바랍니다. 지금부터 아래 최종식을 향해 시작할테니, 천천히 따라오..
- Image source: opee.tistory.com
- Views: 23022
- Publish date: 34 minute ago
- Downloads: 16712
- Likes: 7638
- Dislikes: 1

열역학적 변수는 압력(pressure), 밀도(density), 절대온도(absolute temperature), 엔트로피(entropy) 등이 있습니다.
이번 글이 어렵게 느껴지신다면 여러분들이 부족한 것이 아니라, 제 학문의 깊이와 글짓기 실력이 부족한 것이니 너그럽게 용서해 주시기 바랍니다.
참고로 이상기체는 밀도가 낮아, 분자 간 평균 거리가 충분히 멀어 분자 위치 에너지를 무시할 수 있는 경우를 의미합니다.
제 5장 기체. – ppt download
250C , 1 기압에서 기체로 존재하는 원소
- Image source: slidesplayer.org
- Views: 23507
- Publish date: 14 hours ago
- Downloads: 95687
- Likes: 2823
- Dislikes: 6
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
일반화학 ( 최종호교수님 ) 지정 좌석 배치도 (101 명 / 115 석 ) 교단 DOORDOOR 황승태황승태 김지수김지수 이성종이성종 김보람김보람 신유림신유림 한성화한성화 박세인박세인 박성현박성현 유연경유연경 조용현조용현 정재형정재형 이창혁이창혁 김민겸김민겸 권나솔권나솔.
가. 3 일 취업완성 ! 성취반 _ 성공 취업 반 1 일차 시간 프로그램 내용비고 17:00 ~ 17:10 출석 및 일정 안내 17:10 ~ 18:10 취업 전략 및 채용 프로세스 이해 18:10 ~ 19:30 입사지원서 작성법 및 주요 기업 에세이 작성법 19:30 ~
2-8 이상기체의 열역학 : 압축공기참고서
◆이상기체의 열역학 <매우중요(Very Important)>공기압축기에서 이상기체 열역학적 상태 변화는 크게 보면 모든 부분에서 모두 이루어진다. 그러나 이걸 계산하기는 쉽지 않다. 그래서 이해를 하려면 개별적으로 분석하여 전체적인 개념을 이해해야 한다. 반드시 이해하고 넘어가야 한다. (1) 이상기체의 열역학적 상태 변화 : 이상기체의 열역학적인 상태 변화란 어느 이상기체의 온도, 압력, 부피 등의 물리량 이 변화되는 과정을 의미한다.초기 열역학적 상태에서 나중 열역학적 상태로의 변화 열역학적 상태 : 압력, 부피, 온도가 일정하게 유지되는 하나의 상태로 이상 기체의 열역학적 상태는 이상 기체 상태 방정식을 통해 압력, 부피, 온도 중 두 가지 물리량만 결정되면 나머지 열역학 함수들을 계산할 수 있다. 온도, 압력, 부피가 모두 변하는 과정은 복잡한 수학 지식이 수반되어야 하므로 우선한 가지 물리량은 고정하고 나머지 두 가지 물리량의 변화에 따른 과정을 정리한다.(2) 가역 등압 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.(3) 가역 등적 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.(4) 가역 등온 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다. 온도변화가 없다면 운동에너지 변화가 없으므로 등온 과정에서는 내부 에너지 변화가 없다.(5) 가역 단열 과정① 내부 에너지 변화(△U) – 열역학 제1법칙에 의해 출입된 열과 일의 합으로 구한다.가역변화(reversible change) – 엔트로피 변화의 총합이 0(zero)인 변화비-가역적인 변화가 아닌 변화 즉, 어떤 변화에서 하나의 시스템이 열역학적 상태 S1로부터 시작해서 상태 S2에 도달케 한 다음, 다시 상태 S1로 복귀시키는 경우에, 사용할지도 모르는 다른 물체도 사용 전의 역학적 상태로 복귀시킬 수 있을 때, S1에서 S2로의 변화를 가역변화라고 한다.예를 들면 마찰이 없는 진공 속에서 운동하는 진자는 운동에너지와 위치에너지가 상호 전환하여 주기적으로 원상태로 복귀한다. 이와 같은 변화 즉, 하나의 역학적 상태에서 다른 역학적 상태로의 변화를 반복할 수 있는 경우를 가역변화라 한다. 비-가역변화(irreversible change) – 엔트로피 변화의 총합이 증가물체에 어떤 변화를 가한 다음, 그 상태를 다시 변화 전의 원래의 상태로 복귀시키는 경우, 이때 물체 자신이 다시 원래의 상태로 복귀하면서 다른 어떤 변화를 주위에 남길 경우를 비-가역변화라 한다. (가능한 모든 방법을 사용해도)예를 들면 고온물체와 저온물체를 서로 접촉하면 언젠가는 서로 온도가 같아지게 된다. 그러나 이들을 다시 원래의 온도로 복귀시키고자 할 경우, 고온물체는 가열해야 하고, 저온물체는 냉각시켜야 한다. 가열 또는 냉각시키기 위해서는 별도의 장치를 필요로 하며, 또 주위의 대기 등에 어떤 변화를 남기게 된다. 엔탈피(enthalpy)열역학적 상태를 표시하는 물리량의 하나. 물체 내부 에너지와 밖에서 가해진 압력으로 인한 부피 변화량을 합한 것, 즉 H=U+pV(U는 내부 에너지, p는 압력, V는 부피)로 정의된다. 엔트로피(entropy)열역학에서 중요한 제1법칙은 에너지보존의 법칙, 즉 우주에 존재하는 에너지 총량은 일정하며 절대 변하지 않는다는 것이다. 제2법칙은 대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 이미 진행된 변화를 되돌릴 수 없다는 의미이다. 따라서 자연 물질계의 변화는 엔트로피의 총량이 증가하는 방향으로 진행한다. 이것을 엔트로피 증가의 법칙이라고 한다. 즉 가용할 수 있는 에너지는 일정한데 자연의 물질은 일정한 방향으로만 움직이기 때문에 무용한 상태로 변화한 자연현상이나 물질의 변화는 다시 되돌릴 수 없다는 것이다. 즉 다시 가용할 수 있는 상태로 환원시킬 수 없는, 무용의 상태로 전환된 질량(에너지)의 총량을 '엔트로피(entropy)'고 한다.
- Image source: kiesa.kr
- Views: 42846
- Publish date: 36 minute ago
- Downloads: 37899
- Likes: 2198
- Dislikes: 10

열역학에서 중요한 제1법칙은 에너지보존의 법칙, 즉 우주에 존재하는 에너지 총량은 일정하며 절대 변하지 않는다는 것이다. 제2법칙은 대부분 자연현상의 변화는 어떤 일정한 방향으로만 진행한다. 즉, 이미 진행된 변화를 되돌릴 수 없다는 의미이다. 따라서 자연 물질계의 변화는 엔트로피의 총량이 증가하는 방향으로 진행한다. 이것을 엔트로피 증가의 법칙이라고 한다. 즉 가용할 수 있는 에너지는 일정한데 자연의 물질은 일정한 방향으로만 움직이기 때문에 무용한 상태로 변화한 자연현상이나 물질의 변화는 다시 되돌릴 수 없다는 것이다. 즉 다시 가용할 수 있는 상태로 환원시킬 수 없는, 무용의 상태로 전환된 질량(에너지)의 총량을 ‘엔트로피(entropy)’고 한다.
초기 열역학적 상태에서 나중 열역학적 상태로의 변화 열역학적 상태 : 압력, 부피, 온도가 일정하게 유지되는 하나의 상태로 이상 기체의 열역학적 상태는 이상 기체 상태 방정식을 통해 압력, 부피, 온도 중 두 가지 물리량만 결정되면 나머지 열역학 함수들을 계산할 수 있다. 온도, 압력, 부피가 모두 변하는 과정은 복잡한 수학 지식이 수반되어야 하므로 우선한 가지 물리량은 고정하고 나머지 두 가지 물리량의 변화에 따른 과정을 정리한다.
예를 들면 고온물체와 저온물체를 서로 접촉하면 언젠가는 서로 온도가 같아지게 된다. 그러나 이들을 다시 원래의 온도로 복귀시키고자 할 경우, 고온물체는 가열해야 하고, 저온물체는 냉각시켜야 한다. 가열 또는 냉각시키기 위해서는 별도의 장치를 필요로 하며, 또 주위의 대기 등에 어떤 변화를 남기게 된다.
기체 5.1 기체로 존재하는 물질 5.2 기체의 압력 5.3 기체 법칙 5.4 이상 기체 방정식 5.5 기체의 화학량론 – ppt download
기체의 화학 기체의 화학은 화학의 태동에서부터 매우 중요한 역할을 해 왔다.대부분의 1학년 학생들은 기체의 화학을 중학교나 고등학교에서 배운 보일의 법칙이나 샤를의 법칙 또는 이상기체 방정식을 이해하면 충분하다고 생각할 수 있으나, 기체의 화학은 그 역할이 그보다 매우 크고 중요하다. 물론 출발은 이상기체 방정식이지만, 여기에서 온도의 의미가 나타나고, 또한 기체 분자의 운동과 그 너머의 화학동력학 등을 밝혀냈고, 뿐만 아니라, 상평형, 물질의 화학퍼텐셜 등 화학열역학이 모두 기체의 화학에서 출발한다. 기초를 분명하게 하는 것이 매우 중요하다.
- Image source: slidesplayer.org
- Views: 29348
- Publish date: 2 minute ago
- Downloads: 70249
- Likes: 8672
- Dislikes: 5

기체의 화학은 화학의 태동에서부터 매우 중요한 역할을 해 왔다.대부분의 1학년 학생들은 기체의 화학을 중학교나 고등학교에서 배운 보일의 법칙이나 샤를의 법칙 또는 이상기체 방정식을 이해하면 충분하다고 생각할 수 있으나, 기체의 화학은 그 역할이 그보다 매우 크고 중요하다. 물론 출발은 이상기체 방정식이지만, 여기에서 온도의 의미가 나타나고, 또한 기체 분자의 운동과 그 너머의 화학동력학 등을 밝혀냈고, 뿐만 아니라, 상평형, 물질의 화학퍼텐셜 등 화학열역학이 모두 기체의 화학에서 출발한다. 기초를 분명하게 하는 것이 매우 중요하다.
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
라오디게아 교회의 교훈 본문 계 3: ○라오디게아 교회의 사자에게 편지하라 아멘이시요 충성되고 참된 증인이시요 하나님의 창조의 근본이신 이가 이르시되 15. 내가 네 행위를 아노니 네가 차지도 아니하고 뜨겁지도 아니하도다 네가 차든지 뜨겁든지 하기를 원하노라.
PPT – 5 장 기체 PowerPoint Presentation, free download – ID:635051
5 장 기체. 일반화학 I 2005 년 1 학기 . 5.1 기체. 물질의 세 가지 상태 중 과학자들이 가장 먼저 정량적으로 연구한 상태 보일의 법칙 , 샤를의 법칙 , 돌턴의 부분 압력의 법칙 , 그레이엄의 분출의 법칙 이 법칙들이 기체의 종류에 상관없이 성립되는 까닭은 ? → 기체 분자 운동론 법칙 → 이론 → 새로운 개념. 기체 분자의 운동. 5.1. 5.3 기체 압력 (gas pressure).
- Image source: www.slideserve.com
- Views: 62392
- Publish date: 29 minute ago
- Downloads: 6893
- Likes: 4554
- Dislikes: 8

• 이러한 효과를 포함시킨 실제 기체의 상태 방정식 중의 하나인 반데르발스 식 (P + an2/V2)(V – bn) = nRT a와 b는 기체에 따라 다른 상수들 (반데르발스 상수) • 이상 기체 식 PV = nRT를 실제 기체에 적용할 수 있도록 수정한 것 • 압력에 대한 보정: 분자들이 용기 벽에 충돌할 때 뒤에서 다른 분자들이 끌어당기기 때문에 실제 기체 분자는 이상 기체 분자보다 기벽에 약한 힘을 미침. 실제 기체의 압력을 이상 기체의 압력에 가깝게 만들려면 실측된 값 P에 보정항 an2/V2을 더해 주어야 함.
• 산소, 질소, 수소와 같이 물에 조금밖에 녹지 않는 기체는 수상 치환으로 포집하는데, 이 때 물의 증발에 의해 생긴 수증기도 기체와 함께 포집됨. • 용기 안의 기체의 총압력 = 기체의 압력 + 수증기의 압력 • 22 oC에서 산소를 수상에서 포집했을 때, 기체의 총압력이 735 torr이었다면 산소만의 압력은? [풀이] 여러 온도에서의 수증기의 압력은 표 5.4에 나와 있다. 22 oC에서 수증기의 압력은 19.8 torr이다. PO2 = 735 torr – 19.8 torr = 715 torr
• 성분 1의 몰 분율(mole fraction):x1=n1/ntotal P1 = x1 x Ptotal • [예제 5.19]건조한 공기의 성분은 부피%로 N2 78.08%, O2 20.95%, Ar 0.93%, CO2 0.04%이다. 1.000 기압에서 각 성분 기체의 부분 압력은? [풀이] 기체의 몰 수는 부피에 비례하기 때문에 기체 혼합물의 부피 %와 몰 %는 같다. 부분 압력 = 몰 분율 x 총압력 PN2 = 0.7808 x 1.000 atm = 0.7808 atm 등
기체법칙과 분자운동론 안녕하세요 오늘은 기체법칙과 분자운동론에 대해서 설명해보겠습니다 문찬식. – ppt download
목차 기체 법칙 기체 법칙의 응용 분자운동론 실제기체에서의 적용 먼저 순서를 보면 어떤 기체 법칙들이 있는지 그리고 그 기체법칙들을 어떻게 응용을 하는지, 그 다음에는 이 법칙들을 자세히 들여다 보면 어떤 가정을 가지고 만들어지고 어떻게 운동을 하는지 마지막으로는 이상적인 가정의 기체가 아닌 실제의 기체에는 어떻게 적용하는지에 대해서 알아보겠습니다.
- Image source: slidesplayer.org
- Views: 27657
- Publish date: 7 hours ago
- Downloads: 93797
- Likes: 5206
- Dislikes: 9

We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
일정한 압력에서 일정량의 기체의 온도를 높이면 기체 분자의 평균 운동에너지가 증가하여 기체 분자의 운동이 빨라져 기체 분자가 용기 벽면에 충돌하는 횟수와 세기가 증가하여 기체 압력이 커짐. 기체의 온도가 높아지면 외부 압력이 같아질 때까지 기체의 부피가 증가함 → 일정한 압력에서 기체의 부피는 절대 온도에 비례함
일반화학 ( 최종호교수님 ) 지정 좌석 배치도 (101 명 / 115 석 ) 교단 DOORDOOR 황승태황승태 김지수김지수 이성종이성종 김보람김보람 신유림신유림 한성화한성화 박세인박세인 박성현박성현 유연경유연경 조용현조용현 정재형정재형 이창혁이창혁 김민겸김민겸 권나솔권나솔.
비디오 이상 기체 상태 방정식 [화학] [기체] – 이상기체 방정식
- Source: Youtube
- Views: 100356
- Date: 10 hours ago
- Download: 45352
- Likes: 8789
- Dislikes: 5
주제에 대한 관련 정보 이상 기체 상태 방정식
Bing에서 이상 기체 상태 방정식 주제에 대한 최신 정보를 볼 수 있습니다.
이상기체상태방정식 기체상수
이상기체 상태방정식 문제
이상기체 상태방정식 유도
이상기체 상태 방정식 활용
이상기체 상태방정식 조건
이상기체상태방정식 밀도
이상기체 상태 방정식 단위
이상기체 가정
주제에 대한 기사 보기를 마쳤습니다 이상 기체 상태 방정식. 이 기사가 유용했다면 공유하십시오. 매우 감사합니다.
이상기체상태방정식 기체상수
이상기체 상태방정식 문제
이상기체 상태방정식 유도
이상기체 상태 방정식 활용
이상기체 상태방정식 조건
이상기체상태방정식 밀도
이상기체 상태 방정식 단위
이상기체 가정